MISURE DEL pH DI SOLUZIONI
Scopo dell’esperimento: Misura del pH di soluzioni acquose mediante la colorazione assunta da indicatori acido-base e per mezzo di un piaccametro gestito da un computer.
Premessa: Se si vogliono effettuare misure accurate di pH si usano speciali strumenti di alta precisione, chiamati piaccametri. Tali strumenti consentono la misura diretta del pH con la semplice immersione di uno speciale elettrodo nella soluzione in esame. Nel nostro laboratorio la sonda del pH è gestita da un computer mediante un sistema di misura On-Line. Il valore del pH, con una approssimazione di 0.1 unità, viene letto sul monitor del PC collegato alla sonda mediante un’interfaccia.
Per misure meno precise di pH si utilizzano gli indicatori acido-base che sono sotanze in grado di cambiare colore (viraggio) a seconda dell'acidità ( o della basicità) della soluzione con cui vengono a contatto. Essi sono in genere acidi deboli o basi deboli di origine naturale. Numerosi sono i tipi di indicatori, ognuno dei quali ha un suo intervallo di pH per il viraggio.
Per tarare il piaccametro si utilizzano delle soluzioni tampone le quali hanno la proprietà di mantenere il pH a valori pressoché costanti anche nel caso in cui si aggiungono piccole quantità di ioni H3O+ o di ioni OH-.
- portaprovette
- bacchetta di vetro
- spruzzino con acqua distillata
- soluzioni acquose delle sostanze sottoelencate:
NaOH idrossido di sodio (0.01 M, 0.001 M); HCl acido cloridrico (0.01 M, 0.001 M),
CH3COOH acido acetico(0.1 M, 0.01 M, 0.001 M); H3BO3 acido borico (0.1 M),
CH3COONa acetato di sodio (0.1 M), NaHCO3 bicarbonato di sodio (0.1 M),
NH4Cl cloruro di ammonio (0.1 M), (NH4)2SO4 solfato di ammonio (0.1 M), acqua distillata.
- indicatori acido-base di pH Elenco degli indicatori utilizzati
- personal computer
- interfaccia LabPro (Vernier)
- sensore di pH (Vernier), portata: da 0 a 14 unità pH, sensibilità: 0.005 unità di pH.
- programma LoggerPro (Vernier)
- soluzioni tampone a pH = 4 e pH=7
Esecuzione dell’esperimento
Prima parte. Determinazione del pH di una soluzione mediante l’uso di vari indicatori. Dividete la prima soluzione in quattro porzioni (circa 5 ml ciascuna) da mettere in altrettante provette. Aggiungete nella prima provetta 2-3 gocce di uno degli indicatori per vedere se la soluzione è acida o basica. Si consiglia di iniziare con un indicatore che abbia un intervallo di viraggio vicino al valore di pH = 7, e quindi neutro. In base alla colorazione assunta dalla soluzione aggiungete nella provetta successiva poche gocce dell' indicatori più adatto in modo da avvicinarsi il più possibile all’effettivo valore del pH della soluzione. Ad esempio se il colore assunto dalla soluzione dopo l'aggiunta del primo indicatore mostra che essa è più vicina alla forma acida si passa all'indicatore con intervallo di viraggio più basso, quindi più acido; oppure se si avvicina maggiormente alla forma basica, si passa all'indicatore con intervallo di viraggio maggiore. Per rendere il procedimento più chiaro, si descrive uno dei possibili percorsi, quello che conduce alla determinazione della acidità di una soluzione di HCl.
Aggiungete un paio di gocce di rosso di metile nella prima provetta. Supponiamo che la soluzione diventi rossa dopo l’aggiunta dell’indicatore: allora sapete che è acida. Quindi aggiungete del verde di bromocresolo alla seconda porzione. Supponiamo che la soluzione diventa gialla, significa che il suo pH è minore di 3.8. Allora si potrebbe utilizzare come successivo indicatore il blu timolo, e quindi lo aggiungerete alla terza porzione. Supponiamo che a questo punto la soluzione diventi ancora gialla, segno che il suo pH è maggiore di 2.7. Allora l’ultimo indicatore da aggiungere alla quarta porzione di soluzione è il blu di bromofenolo. Se la soluzione diventa gialla giungete alla conclusione che il pH della vostra soluzione è compreso tra 2.7 e 3.

La soluzione iniziale di HCl è incolore. Dopo l'aggiunta di un paio di gocce di rosso metile nella provetta la comparsa della colorazione rossa sta a significare che la soluzione è acida.
In modo analogo procedete con le altre soluzioni, dopo aver versato la soluzione analizzata in una beuta e sciacquato le provette con acqua corrente, descrivendo i colori osservati per ogni prova e le informazioni che ne ricavate.
Seconda parte. Determinazione del pH di una soluzione mediante il piaccametro. Sul computer deve essere installato il programma LoggerPro. Accendete il computer, collegare l’interfaccia al suo alimentatore e al computer mediante i cavetti appositi. Dopo aver connesso il sensore di pH al canale 1 dell'interfaccia avviare il programma LoggerPro. Se il programma non autoriconosce la sonda dal menu IMPOSTAZIONI-SENSORI scegliere l’opzione pH-Probe. Prima dell’uso del piaccametro è necessario calibrarlo, soprattutto se non è stato adoperato per un lungo tempo. Per calibrarlo, preparate due soluzioni di cui conoscete esattamente il pH, ad esempio una soluzione tampone con pH intorno a 7 e una con pH 4. Sfilate dall’estremità del sensore l’apposita bottiglietta che protegge l’elettrodo. Lavate l’elettrodo con acqua distillata e asciugatelo delicatamente. Immergete l’elettrodo nella soluzione con pH 7. Dal menu ESPERIMENTO-CALIBRAZIONE, quando il valore di tensione in corrispondenza del primo punto di calibrazione che compare nella schermata è stabile confermate tale valore. Togliete l’elettrodo dalla soluzione, lavatelo con acqua distillata e asciugatelo come prima. Poi immergetelo nella soluzione tampone con pH 4. Aspettate che anche il valore di tensione in corrispondenza del secondo punto di calibrazione si stabilizzi e confermate tale valore.
A questo punto il piaccametro è pronto per l’uso: quando immergete il suo elettrodo nella soluzione in esame, il computer vi indica il valore del pH di quella soluzione.
Considerazioni finali: Osservando la tabella di esempio delle misure eseguite del pH delle soluzioni si possono fare le seguenti interessanti considerazioni.
Poichè il pH è un numero correlato alla concentrazione deglio ioni H+, ci si dovrebbe aspettare che due soluzioni di acidi che hanno la stessa concentrazione, come l'acido cloridrico e l'acido acetico, presentino lo stesso pH, ma non è così. Infatti la soluzione di HCl 0,01 M ha pH = 2 mentre la soluzione di CH3COOH avente la stessa concentrazione ha pH = 3,4. Le cause di questa differenza sono dovute al fatto che l'acido cloridrico è un acido forte, vale a dire che in acqua si ionizza completamente e quindi ciascuna molecola di HCl dà origine ad uno ione H+e ad uno ione Cl- , mentre l'acido acetico si ionizza solo in piccola parte perchè è un acido debole e forma quindi pochi ioni H+ e un ugual numero di ioni CH3COOH-. In conclusione, mentre la concentrazione degli acidi è la stessa la concentrazione degli ioni, e pertanto anche il grado di acidità o pH della soluzione, è molto diversa. (*)
Il valore del pH è tanto più basso quanto più la soluzione acida è concentrata. Infatti quando la concentrazione degli ioni H+ diventa 10 volte maggiore, come ad esempio passando dalla soluzione di HCl 0.001 M a 0.01 M, il valore del pH diminuisce di una unità, e precisamente da 3 a 2.
E' stato verificato che le soluzioni acquose di sali che si possono considerare derivati da acidi forti e basi deboli danno luogo a soluzioni acide. Infatti la soluzione di cloruro di ammonio, NH4Cl, che deriva dalla base debole ammoniaca NH3e dall'acido forte HCl presenta un valore di pH inferiore a 7, e precisamente 5,1. La reazione di dissociazione che avviene quando il cloruro di ammonio è sciolto in acqua è:
NH4Cl (s) ® NH4+(aq) + Cl-(aq) (**)
Lo ione ammonio, a differenza dello ione Cl- reagisce con l'acqua nel seguente modo:
NH4+(aq) + H2O (l) « NH3(aq) + H3O+(aq) (***)
In seguito a tale reazione, la concentrazione di ioni idronio H3O+ in soluzione diventa maggiore di quella presente nell'acqua distillata e, quindi, il pH si sposta verso un valore inferiore a 7: si dice che è avvenuta un'idrolisi acida.
Le soluzioni acquose di sali che si possono considerare derivati da acidi deboli e basi forti danno luogo a soluzioni basiche. Infatti la soluzione di acetato di sodio CH3COONa, derivante dall'acido debole CH3COOH e dalla base forte NaOH, ha un pH di 8,9. Quando l'acetato di sodio è sciolto in acqua, è completamente dissociato nei suoi ioni Na+ e CH3COO- secondo la seguente equazione di equilibrio:
CH3COONa (s) + H2O (l) « CH3COO-(aq) + Na+(aq)
lo ione acetato CH3COO- a differenza dello ione sodio reagisce con l'acqua secondo la reazione di equilibrio:
CH3COO-(aq) + H2O (l) « CH3COOH(aq) + OH-(aq)
Quindi la soluzione arricchendosi di ioni OH- risulta basica: si dice che è avvenuta un'idrolisi basica.
Il bicarbonato di sodio dà un pH lievemente basico. Esso infatti viene usato per neutralizzare parzialmente l'iperacidità dello stomaco.
Considerazioni analoghe si possono svolgere nel caso della basi. In particolare si osserva che che la soluzione di idrossido di sodio pur essendo meno concentrata di quella di bicarbonato di sodio ha un valore di pH più alto e quindi ha un grado di basicità superiore. Ciò avviene perchè NaOH è una base forte mentre NaHCO3 è una base debole.
Durante le misure del pH mediante il sistema di misura On-Line può essere necessario tarare la sonda più di una volta , soprattutto se le soluzioni da analizzare sono molte. In tal caso si può evitare di immergere nuovamente la sonda nelle soluzioni tampone. Basta infatti, dopo la prima taratura, prendere nota dei parametri geometrici della retta di taratura, valori che sono indicati nel software Logger Pro nei menu ESPERIMENTO-CALIBRAZIONE-DETTAGLI sotto le voci INTERCEPT (intercetta) e SLOPE (pendenza). Se tali valori cambiano sensibilmente durante le misure basta reimpostarli per riottenere la taratura della sonda.
E' evidente che la misura del pH mediante gli indicatori acido-base fornisce dei valori meno precisi rispetto al piaccametro Tuttavia vi è da rilevare che i valori ottenibili con i due sistemi di misura non sono poi così molto diversi tra di loro come mostra la tabella riepilogativa di una serie di misure eseguite con i due sistemi. Quindi, in conclusione, quando non è richiesta una grande precisione l'uso degli indicatori è un metodo tutto sommato affidabile e che ha il vantaggio della semplicità ed economicità. Quando invece è richiesta una grande precisione è indispensabile utilizzare il piaccametro ricordando che è necessario prestare ben attenzione alla taratura della sonda.
Note.
(*) Da notare che non tutti i
composti che conte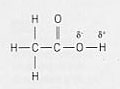 ngono idrogeno sono acidi o che tutti gli idrogeni presenti in un
acido si ionizzano come ioni idrogeno; sono ionizzabili soltanto gli idrogeni impegnati
in legami fortemente polari. E' questo il caso di un composto covalente polare come
l'HCl che a contatto con l'acqua libera ioni H+. Nel caso, invece, del metano
(CH4) i quattro idrogeni sono legati al carbonio con legami debolmente polari e
perciò non sono ionizzabili; pertanto il metano non è un acido. L'acido acetico presenta
una situazione diversa poichè i suoi tre atomi di idrogeno legati al carbonio sono uniti
in legami debolmente polari e non si ionizzano, mentre è ionizzabile l'atomo di idrogeno
legato all'ossigeno come mostra la figura. Gli acidi che contengono un solo idrogeno
ionizzabile sono detti monoprotici (per esempio HCl). Gli acidi che contengono due o più
idrogeni ionizzabili sono detti politropici: per esempio l'acido solforico H2SO4
è diprotico.
ngono idrogeno sono acidi o che tutti gli idrogeni presenti in un
acido si ionizzano come ioni idrogeno; sono ionizzabili soltanto gli idrogeni impegnati
in legami fortemente polari. E' questo il caso di un composto covalente polare come
l'HCl che a contatto con l'acqua libera ioni H+. Nel caso, invece, del metano
(CH4) i quattro idrogeni sono legati al carbonio con legami debolmente polari e
perciò non sono ionizzabili; pertanto il metano non è un acido. L'acido acetico presenta
una situazione diversa poichè i suoi tre atomi di idrogeno legati al carbonio sono uniti
in legami debolmente polari e non si ionizzano, mentre è ionizzabile l'atomo di idrogeno
legato all'ossigeno come mostra la figura. Gli acidi che contengono un solo idrogeno
ionizzabile sono detti monoprotici (per esempio HCl). Gli acidi che contengono due o più
idrogeni ionizzabili sono detti politropici: per esempio l'acido solforico H2SO4
è diprotico.
(**) Nella reazione la scrittura (aq) indica che gli ioni in soluzione acquosa sono idratati cioè circondati da molecole d'acqua. In particolare lo ione idronio si ammette che possa associarsi a un numero variabile da 1 a 3 molecole d'acqua tramite legami a idrogeno.
(***) Nelle reazioni dove sono coinvolti acidi o basi deboli il simbolo « indica che si instaura un equilibrio tra la parte ionizzata e la parte non ionizzata.